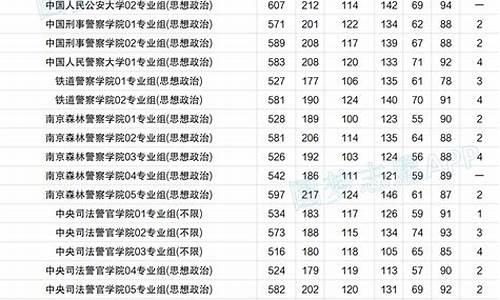
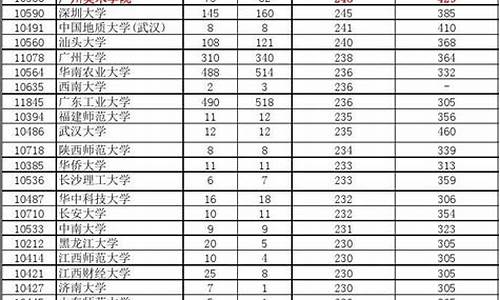
您现在的位置是: 首页 > 教育改革 教育改革
高考化学氧化还原反应专题_高考氧化还原专题
tamoadmin 2024-05-21 人已围观
简介10HNO3+4Zn=NH4NO3+4Zn(NO3)2+3H2O 首先先标出变化了的元素的化合价 包括反应前后。(化合价无变化的不标,如本例中的H和O元素) +5 0 -3 +5 +2 +5 H N O3 + Zn = N H4 N O3 + Zn ( N O3 ) + H2 O可以看到只有N的化合价降低了 也只有Zn的化合价上升了。化合价上升多少可看作是失去多

10HNO3+4Zn=NH4NO3+4Zn(NO3)2+3H2O
首先先标出变化了的元素的化合价 包括反应前后。(化合价无变化的不标,如本例中的H和O元素)
+5 0 -3 +5 +2 +5
H N O3 + Zn = N H4 N O3 + Zn ( N O3 ) + H2 O
可以看到只有N的化合价降低了 也只有Zn的化合价上升了。
化合价上升多少可看作是失去多上电子 同样化合价降低多少可认为得到多少电子。
由电子守恒即可配平 变化的元素 再利用观察法即可将整个式子配平
10HNO3+4Zn=NH4NO3+4Zn(NO3)2+3H2O
观察法:就是在原来的基础上(系数比例不变),观察一种元素保证其前后的量一致在该题中 就是现配平剩余的氧或者氢在配平剩下的一种
详细说明
第一步,跟据化合价的升降来配平化合价有变化的元素
HNO3+4Zn _ NH4NO3+Zn(NO3)2+H2O
第二步,根据锌守恒在Zn(NO3)前配4
HNO3+4Zn _ NH4NO3+4Zn(NO3)2+H2O
第三步,根据N守恒在HNO3前配10(可看作一个N化合价变化了的HNO3+9个未变化的HNO3)
10HNO3+4Zn _ NH4NO3+4Zn(NO3)2+H2O
第四步,根据氧守恒在H2O前配3
10HNO3+4Zn _ NH4NO3+4Zn(NO3)2+3H2O
第五步,根据H验证是否配平衡(既反应前等于反应后),相等后短线改为等号
10HNO3+4Zn=NH4NO3+4Zn(NO3)2+3H2O
希望你能懂 所谓观察法就是利用元素守恒(反应前后元素的总数量不会改变)来配平