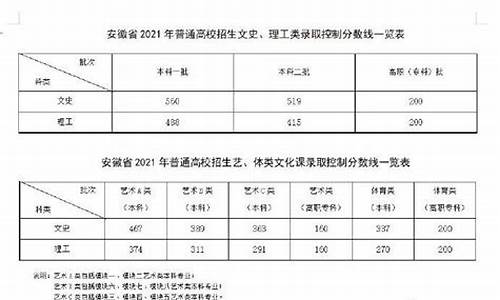
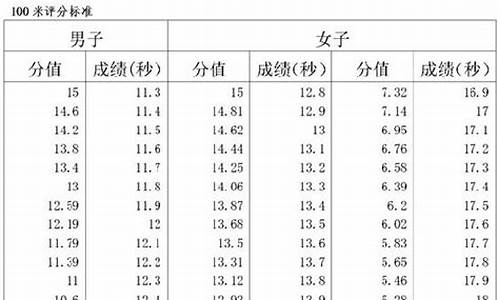
您现在的位置是: 首页 > 教育比较 教育比较
西城二模化学2021高三,西城二模化学高考
tamoadmin 2024-07-29 人已围观
简介1.化学啊 高考二模的一道计算题 求救啊 关于NO2和N2O42.2012西城区初三二模化学33题{实验结论}3.化学 高三二模4.高考化学复习:河西化学二模题:将质量相等的四份铁粉和铜粉的均匀混合物,分别加入同浓2009届高考选择题专题训练第一套元素化合物1、(06东城二模11)下列说法不正确的是( )A.活性炭、SO2、Na2O2都能使品红溶液褪色,但原理不同B.同温同压下,两份相同质
1.化学啊 高考二模的一道计算题 求救啊 关于NO2和N2O4
2.2012西城区初三二模化学33题{实验结论}
3.化学 高三二模
4.高考化学复习:河西化学二模题:将质量相等的四份铁粉和铜粉的均匀混合物,分别加入同浓

2009届高考选择题专题训练第一套
元素化合物
1、(06东城二模11)下列说法不正确的是( )
A.活性炭、SO2、Na2O2都能使品红溶液褪色,但原理不同
B.同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积不
相等
C.将SO2气体通人BaCl2溶液中至饱和,未见沉淀生成,继续通人NO2则有沉淀生成
D.将Cl2通人NaBr、NaI的混合溶液中,反应后将溶液蒸干并充分灼烧,剩余的固体物质成分为NaCl
2、(06西城二模8)下列事实能用同一原理解释的是( )
A.SO2和C12都能用于漂白 B.苯酚、乙烯都能跟溴水反应
C.苏打、小苏打水溶液的pH都大于7 D.I2、NH4Cl晶体受热都逐渐消失
3、(06东城一模9)下列各组物质相互混合进行反应,既有气体生成最终又有沉淀生成的是( )
①金属钠投入CuSO4溶液中 ②过量的NaOH溶液和明矾溶液反应
③少量电石投入过量的NaHCO3溶液中 ④金属铝投入KOH溶液中
A.①③ B.①④ C.②④ D.②③
4、(06东城一模12)一定质量的铜和足量的硝酸反应,所放出的气体与标准状况下的氧气1.12 L混合后再通入水中,恰好被完全吸收,则铜的质量为
A.3.2 g B.4.8 g C.6.4 g D.10.8 g
5、(06西城一模8)能将分别含有Fe3+、A13+、Fe2+、Mg2+、NH4+离子的五种溶液一次性鉴别开来的试剂是
A.KSCN溶液 B.稀HNO3 C.NaOH溶液 D.氨水
6、(06西城一模9)下列各组中的两种物质相互反应,无论这两种物质用量比例如何,都能用同一离子方程式表示的是
A.偏铝酸钠和盐酸 B.澄清石灰水和二氧化碳
C.硝酸银和稀氨水 D.碳酸氢钠和盐酸
7、(06西城二模8)下列事实能用同一原理解释的是
A.SO2和C12都能用于漂白 B.苯酚、乙烯都能跟溴水反应
C.苏打、小苏打水溶液的pH都大于7 D.I2、NH4Cl晶体受热都逐渐消失
8、(06宣武二模)9.下列说法错误的是
A.Na2SO3溶液与BaCl2溶液混合有白色沉淀生成,加稀HNO3沉淀不消失
B.将SO2气体通入足量Ba(OH)2溶液中有白色沉淀生成,加足量HCl后沉淀消失
C.将SO2气体通入BaCl2溶液中有白色沉淀生成,加稀HCl后沉淀消失
D.将SO2气体通入氯水中无明显现象,加入BaCl2溶液有白色沉淀生成
9、(06丰台二模)7.下列各组中的两种物质相互反应时,无论哪种过量,都可以用同一离子反应方程式表示的是
A.偏铝酸钾溶液和盐酸 B.氨水和硝酸银溶液
C.二氧化硫和氢氧化钠溶液 D.苯酚钠溶液和二氧化碳
10、(06朝阳二模)6.过氧化氢水溶液俗称双氧水,下列说法不正确的是
A.H2O2中既有极性键又有非极性键
B.双氧水显弱酸性,原因是发生了H2O2 H+ + HO2-
C.H2O2只有氧化性 D.双氧水可漂白羽毛
11、(06东城三模)9.甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种,若将丁溶液滴入乙溶液中,有白色沉淀生成,继续滴加则沉淀消失;丁溶液滴入甲溶液中,无明显现象,据此可推断丙物质是
A.Al2(SO4)3 B.NaOH C.BaCl2 D.FeSO4
12、(08顺义一模-6).同位素示踪法可用于反应机理的研究,下列反应中同位素示踪表示正确的是
A . 2Na218O2 + 2H2O == 4Na18OH + O2↑
B . 2KMnO4 + 5H218O2 + 3H2SO4 == K2SO4 + 2MnSO4 + 518O2↑ + 8H2O
C . NH4Cl + 2H2O NH3? 2H2O + HCl
D . K37ClO3 + 6HCl == K37Cl + 3Cl2 ↑+ 3H2O
13、(08江苏卷)下列现象或事实可用同一原理解释的是( )
A.浓硫酸和浓盐酸长期暴露在空气中浓度降低
B.氯水和活性炭使红墨水褪色
C.漂和水玻璃长期暴露会变质
D.乙炔和乙烯使溴的四氯化炭溶液褪色
化学啊 高考二模的一道计算题 求救啊 关于NO2和N2O4
首先可以排除C和D,因为此反应是高锰酸钾反应制取氧气,参加反应的反应物的质量等于生成物的质量。但是生成物中有气体会逸出,所以固体反应物的质量肯定大于剩余固体物质的质量。而通过B计算,刚好是等于10%,与题目不符,所以也排除。选答案A。
2012西城区初三二模化学33题{实验结论}
LZ有问题啊。。。只打第三小题。。缺条件让人怎么做啊?
我上网查了一下。。。平均摩尔质量是55.2g/mol
由此十字相乘可得NO2:N2O4=4:1
而差量法所得,氧元素的物质的量是1.92/16=0.12mol
所以可以得到NO2=0.04mol,N2O4=0.01mol
0.05*22.4=1.12L
化学 高三二模
答案 比较详细了。给你补充下氢氧化钙怎么判断出来的。
残留固体1.6g 是残渣B(碳酸钙1.0g)+残渣C1.0g,如果C只有氧化钙变成的那么残留固体只有1.56g(根据元素守恒来的),所以必有氢氧化钙
高考化学复习:河西化学二模题:将质量相等的四份铁粉和铜粉的均匀混合物,分别加入同浓
D:冷凝管必须装满水才能很好的起到冷却作用嘛
如果从上口进水的话,进去的水还没把冷凝管填满马上有从下口流出了,不能起到冷凝作用了;反之,如果下口进水,水就得填满冷凝管后才能从上口溢出,明白了吗?
另外,如果是下口进上口出还有一个好处,就是水流方向与气流方向相反,更能冷凝充分。
C:你考虑的太过仔细了
先放下层液体,你想到的是会有少许残留在分液漏斗内壁上,所以会污染。但是即使有残留,量也很少,也不溶于上层液体,在上层液体的重用下,在分液时这些液体有下坠的趋势。
分液后,如果我们需要的是上层液体,则可往下层多放一点点,保证分界处的下层液体被全部放出。
任何操作都不可能达到绝对百分百的效果,极少量的杂质仍存在这是允许的。跟溶液中除杂道理一样(溶液中离子浓度<10-5mol/l不就视为沉淀完全吗?)
根据题给数据可知,实验①、②都有金属剩余,则反应后的溶液中不可能含有硝酸铁,溶液中金属离子为亚铁离子和铜离子,实验②是在实验①的基础上加入100mL硝酸,参加反应的金属的质量为8.4g,生成NO的体积为2240mL,物质的量为0.1mol,根据电子转移守恒可知,参加反应金属的物质的量为0.1mol×(5—2)/2=0.15mol,参加反应金属的摩尔质量为56g/mol,该过程只有Fe参加反应,故实验①只有Fe参与反应,根据NO的体积结合方程式计算参加反应Fe的物质的量、硝酸的物质的量,根据m=nM计算参加反应Fe的质量,根据c=nV计算硝酸的物质的量浓度;在实验②的基础上加入100mL硝酸,参加反应的金属的质量为9.6g,生成NO的体积为2240mL,物质的量为0.1mol,若该过程只有Cu参加反应,根据电子转移守恒,则Cu的物质的量0.15mol,Cu的质量9.6g,等于参加反应金属的质量,故该过程只有Cu反应,且Cu恰好完全反应,则加入200mL硝酸时,Fe恰好反应生成硝酸亚铁,在实验③的基础上再加入100mL硝酸,硝酸与溶液中亚铁离子反应生成NO,根据亚铁离子的物质的量,利用电子转移守恒计算该阶段生成NO的物质的量,再根据V=nVm计算该阶段生成NO的体积,进而计算V的值。A、根据上述分析可知,实验①发生反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,生成NO的物质的量为0.1mol,根据方程式可知,参加反应铁的物质的量为0.15mol,质量为8.4g,错误;B、根据上述分析可知,实验①发生反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,生成NO的物质的量为0.1mol,根据方程式可知,参加反应的硝酸的物质的量为0.4mol,故硝酸的物质的量浓度4mol/L,错误;C、由上述分析可知,实验②中参加反应的金属为Fe,Cu没有参加反应,错误;D、由上述分析可知,实验②中Fe与硝酸恰好反应生成硝酸亚铁,生成NO的物质的量0.2mol,由3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O可知,溶液中亚铁离子的物质的量为0.3mol,在实验③的基础上再加入100mL硝酸,为硝酸与溶液中亚铁离子反应生成NO,根据电子转移守恒可知,生成NO的物质的量0.1mol,体积为2240mL,V=6720+2240=8960,正确。