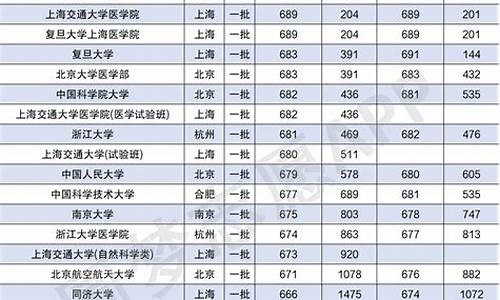
您现在的位置是: 首页 > 教育比较 教育比较
高考理科数学公式_高考理科数学公式汇总
tamoadmin 2024-06-13 人已围观
简介1.2014重庆高考数学试题选择题第10题详解(理科)2.高中文科数学公式总结大全3.数列{An}的前n项和为Sn,满足Sn=2nAn+1-3n^2-4n,n属于N*,14年广东高考理科19题有木有大神在啊 求解答4.高中所有理科的公式、知道滴请回复5.2019年天津高考理科数学真题试卷及答案与解析6.重庆2021年高考数学平均分理科生的浪漫——数学公式如下:1、你就像∫f(x′)dx,而我正如f
1.2014重庆高考数学试题选择题第10题详解(理科)
2.高中文科数学公式总结大全
3.数列{An}的前n项和为Sn,满足Sn=2nAn+1-3n^2-4n,n属于N*,14年广东高考理科19题有木有大神在啊 求解答
4.高中所有理科的公式、知道滴请回复
5.2019年天津高考理科数学真题试卷及答案与解析
6.重庆2021年高考数学平均分

理科生的浪漫——数学公式如下:
1、你就像∫f(x′)dx,而我正如f(x),我只不过是你的一个选择,而你却是我唯一的答案。
2、有时候真的希望,你的视线和我的视线,永远是一堆相反向量。
3、失去你我会很失落,因为遇见再喜欢上一个人,它的概率是无数个小事件的概率积。
4、我还是很喜欢你,像sin平方加cos平方,始终如一 。
5、我们就像两个同心圆,不管半径是否相同,我们的心永远在一起。
6、我对你的思念就像无限循环小数,一遍一遍永不停息。
7、如果有一天,我们被袭分隔到异面直线的两头,我一定穿越时空的阻隔,划条公垂线,向你冲来。
8、如果我们不小心走到数轴的两端,正负无穷,再难相见,没有关系,我只要求个倒数,我们就能心心相依,永远相伴。
2014重庆高考数学试题选择题第10题详解(理科)
仰望天空时,什么都比你高,你会自卑;俯视大地时,什么都比你低,你会自负;只有放宽视野,把天空和大地尽收眼底,才能在苍穹泛土之间找到你真正的位置。无须自卑,不要自负,坚持自信。努力学习,冲刺高考,我带来的 高三数学 理科知识点归纳,祝你金榜题名
高三数学理科知识点归纳1
一、求动点的轨迹方程的基本步骤
⒈建立适当的坐标系,设出动点M的坐标;
⒉写出点M的集合;
⒊列出方程=0;
⒋化简方程为最简形式;
⒌检验。
二、求动点的轨迹方程的常用 方法 :求轨迹方程的方法有多种,常用的有直译法、定义法、相关点法、参数法和交轨法等。
⒈直译法:直接将条件翻译成等式,整理化简后即得动点的轨迹方程,这种求轨迹方程的方法通常叫做直译法。
⒉定义法:如果能够确定动点的轨迹满足某种已知曲线的定义,则可利用曲线的定义写出方程,这种求轨迹方程的方法叫做定义法。
⒊相关点法:用动点Q的坐标x,y表示相关点P的坐标x0、y0,然后代入点P的坐标(x0,y0)所满足的曲线方程,整理化简便得到动点Q轨迹方程,这种求轨迹方程的方法叫做相关点法。
⒋参数法:当动点坐标x、y之间的直接关系难以找到时,往往先寻找x、y与某一变数t的关系,得再消去参变数t,得到方程,即为动点的轨迹方程,这种求轨迹方程的方法叫做参数法。
⒌交轨法:将两动曲线方程中的参数消去,得到不含参数的方程,即为两动曲线交点的轨迹方程,这种求轨迹方程的方法叫做交轨法。
_直译法:求动点轨迹方程的一般步骤
①建系——建立适当的坐标系;
②设点——设轨迹上的任一点P(x,y);
③列式——列出动点p所满足的关系式;
④代换——依条件的特点,选用距离公式、斜率公式等将其转化为关于X,Y的方程式,并化简;
⑤证明——证明所求方程即为符合条件的动点轨迹方程。
高三数学理科知识点归纳2
1.函数的奇偶性
(1)若f(x)是偶函数,那么f(x)=f(-x);
(2)若f(x)是奇函数,0在其定义域内,则f(0)=0(可用于求参数);
(3)判断函数奇偶性可用定义的等价形式:f(x)±f(-x)=0或(f(x)≠0);
(4)若所给函数的解析式较为复杂,应先化简,再判断其奇偶性;
(5)奇函数在对称的单调区间内有相同的单调性;偶函数在对称的单调区间内有相反的单调性;
2.复合函数的有关问题
(1)复合函数定义域求法:若已知的定义域为[a,b],其复合函数f[g(x)]的定义域由不等式a≤g(x)≤b解出即可;若已知f[g(x)]的定义域为[a,b],求f(x)的定义域,相当于x∈[a,b]时,求g(x)的值域(即f(x)的定义域);研究函数的问题一定要注意定义域优先的原则。
(2)复合函数的单调性由“同增异减”判定;
3.函数图像(或方程曲线的对称性)
(1)证明函数图像的对称性,即证明图像上任意点关于对称中心(对称轴)的对称点仍在图像上;
(2)证明图像C1与C2的对称性,即证明C1上任意点关于对称中心(对称轴)的对称点仍在C2上,反之亦然;
(3)曲线C1:f(x,y)=0,关于y=x+a(y=-x+a)的对称曲线C2的方程为f(y-a,x+a)=0(或f(-y+a,-x+a)=0);
(4)曲线C1:f(x,y)=0关于点(a,b)的对称曲线C2方程为:f(2a-x,2b-y)=0;
(5)若函数y=f(x)对x∈R时,f(a+x)=f(a-x)恒成立,则y=f(x)图像关于直线x=a对称;
(6)函数y=f(x-a)与y=f(b-x)的图像关于直线x=对称;
4.函数的周期性
(1)y=f(x)对x∈R时,f(x+a)=f(x-a)或f(x-2a)=f(x)(a>0)恒成立,则y=f(x)是周期为2a的周期函数;
(2)若y=f(x)是偶函数,其图像又关于直线x=a对称,则f(x)是周期为2︱a︱的周期函数;
(3)若y=f(x)奇函数,其图像又关于直线x=a对称,则f(x)是周期为4︱a︱的周期函数;
(4)若y=f(x)关于点(a,0),(b,0)对称,则f(x)是周期为2的周期函数;
(5)y=f(x)的图象关于直线x=a,x=b(a≠b)对称,则函数y=f(x)是周期为2的周期函数;
(6)y=f(x)对x∈R时,f(x+a)=-f(x)(或f(x+a)=,则y=f(x)是周期为2的周期函数;
5.方程k=f(x)有解k∈D(D为f(x)的值域);
6.a≥f(x)恒成立a≥[f(x)]max,;a≤f(x)恒成立a≤[f(x)]min;
7.(1)(a>0,a≠1,b>0,n∈R+);
(2)logaN=(a>0,a≠1,b>0,b≠1);
(3)logab的符号由口诀“同正异负”记忆;
(4)alogaN=N(a>0,a≠1,N>0);
8.判断对应是否为映射时,抓住两点:
(1)A中元素必须都有象且;
(2)B中元素不一定都有原象,并且A中不同元素在B中可以有相同的象;
9.能熟练地用定义证明函数的单调性,求反函数,判断函数的奇偶性。
10.对于反函数,应掌握以下一些结论:
(1)定义域上的单调函数必有反函数;
(2)奇函数的反函数也是奇函数;
(3)定义域为非单元素集的偶函数不存在反函数;
(4)周期函数不存在反函数;
(5)互为反函数的两个函数具有相同的单调性;
(6)y=f(x)与y=f-1(x)互为反函数,设f(x)的定义域为A,值域为B,则有f[f--1(x)]=x(x∈B),f--1[f(x)]=x(x∈A);
11.处理二次函数的问题勿忘数形结合
二次函数在闭区间上必有最值,求最值问题用“两看法”:一看开口方向;二看对称轴与所给区间的相对位置关系;
12.依据单调性
利用一次函数在区间上的保号性可解决求一类参数的范围问题;
13.恒成立问题的处理方法
(1)分离参数法;
(2)转化为一元二次方程的根的分布列不等式(组)求解;
高三数学理科知识点归纳3
1.进行集合的交、并、补运算时,不要忘了全集和空集的特殊情况,不要忘记了借助数轴和文氏图进行求解.
2.在应用条件时,易A忽略是空集的情况
3.你会用补集的思想解决有关问题吗?
4.简单命题与复合命题有什么区别?四种命题之间的相互关系是什么?如何判断充分与必要条件?
5.你知道“否命题”与“命题的否定形式”的区别.
6.求解与函数有关的问题易忽略定义域优先的原则.
7.判断函数奇偶性时,易忽略检验函数定义域是否关于原点对称.
8.求一个函数的解析式和一个函数的反函数时,易忽略标注该函数的定义域.
9.原函数在区间[-a,a]上单调递增,则一定存在反函数,且反函数也单调递增;但一个函数存在反函数,此函数不一定单调
10.你熟练地掌握了函数单调性的证明方法吗?定义法(取值,作差,判正负)和导数法
11.求函数单调性时,易错误地在多个单调区间之间添加符号“∪”和“或”;单调区间不能用集合或不等式表示.
12.求函数的值域必须先求函数的定义域。
13.如何应用函数的单调性与奇偶性解题?①比较函数值的大小;②解抽象函数不等式;③求参数的范围(恒成立问题).这几种基本应用你掌握了吗?
14.解对数函数问题时,你注意到真数与底数的限制条件了吗?
(真数大于零,底数大于零且不等于1)字母底数还需讨论
15.三个二次(哪三个二次?)的关系及应用掌握了吗?如何利用二次函数求最值?
16.用换元法解题时易忽略换元前后的等价性,易忽略参数的范围。
17.“实系数一元二次方程有实数解”转化时,你是否注意到:当时,“方程有解”不能转化为。若原题中没有指出是二次方程,二次函数或二次不等式,你是否考虑到二次项系数可能为的零的情形?
18.利用均值不等式求最值时,你是否注意到:“一正;二定;三等”.
19.绝对值不等式的解法及其几何意义是什么?
20.解分式不等式应注意什么问题?用“根轴法”解整式(分式)不等式的注意事项是什么?
21.解含参数不等式的通法是“定义域为前提,函数的单调性为基础,分类讨论是关键”,注意解完之后要写上:“综上,原不等式的解集是……”.
22.在求不等式的解集、定义域及值域时,其结果一定要用集合或区间表示;不能用不等式表示.
23.两个不等式相乘时,必须注意同向同正时才能相乘,即同向同正可乘;同时要注意“同号可倒”即a>b>0,a<0.
24.解决一些等比数列的前项和问题,你注意到要对公比及两种情况进行讨论了吗?
25.在“已知,求”的问题中,你在利用公式时注意到了吗?(时,应有)需要验证,有些题目通项是分段函数。
26.你知道存在的条件吗?(你理解数列、有穷数列、无穷数列的概念吗?你知道无穷数列的前项和与所有项的和的不同吗?什么样的无穷等比数列的所有项的和必定存在?
27.数列单调性问题能否等同于对应函数的单调性问题?(数列是特殊函数,但其定义域中的值不是连续的。)
28.应用数学归纳法一要注意步骤齐全,二要注意从到过程中,先假设时成立,再结合一些数学方法用来证明时也成立。
29.正角、负角、零角、象限角的概念你清楚吗?,若角的终边在坐标轴上,那它归哪个象限呢?你知道锐角与第一象限的角;终边相同的角和相等的角的区别吗?
30.三角函数的定义及单位圆内的三角函数线(正弦线、余弦线、正切线)的定义你知道吗?
31.在解三角问题时,你注意到正切函数、余切函数的定义域了吗?你注意到正弦函数、余弦函数的有界性了吗?
32.你还记得三角化简的通性通法吗?(切割化弦、降幂公式、用三角公式转化出现特殊角.异角化同角,异名化同名,高次化低次)
33.反正弦、反余弦、反正切函数的取值范围分别是
34.你还记得某些特殊角的三角函数值吗?
35.掌握正弦函数、余弦函数及正切函数的图象和性质.你会写三角函数的单调区间吗?会写简单的三角不等式的解集吗?(要注意数形结合与书写规范,可别忘了),你是否清楚函数的图象可以由函数经过怎样的变换得到吗?
36.函数的图象的平移,方程的平移以及点的平移公式易混:
(1)函数的图象的平移为“左+右-,上+下-”;如函数的图象左移2个单位且下移3个单位得到的图象的解析式为y=2(x+2)+4-3,即y=2x+5.
(2)方程表示的图形的平移为“左+右-,上-下+”;如直线左移2个个单位且下移3个单位得到的图象的解析式为2(x+2)-(y+3)+4=0,即y=2x+5.
(3)点的平移公式:点P(x,y)按向量平移到点P(x,y),则x=x+hy=y+k.
37.在三角函数中求一个角时,注意考虑两方面了吗?(先求出某一个三角函数值,再判定角的范围)
38.形如的周期都是,但的周期为。
39.正弦定理时易忘比值还等于2R。
高三数学理科知识点归纳相关 文章 :
★ 高三数学知识点考点总结大全
★ 高三数学知识点梳理汇总
★ 高考数学知识点归纳整理
★ 高三数学重点知识总结大全
★ 高三数学知识点总结归纳
★ 高三数学知识点总结及数学学习方法
★ 高考数学知识点整理
★ 高三数学知识点考点大全
★ 高考数学知识点归纳总结
高中文科数学公式总结大全
分析:根据正弦定理和三角形的面积公式,利用不等式的性质 进行证明即可得到结论.
解答:
解:
∵△ABC的内角A,B,C满足sin2A+sin(A-B+C)=sin(C-A-B)+1/2,
∴sin2A+sin2B=-sin2C+1/2,
∴sin2A+sin2B+sin2C=1/2,
∴2sinAcosA+2sin(B+C)cos(B-C)=1/2,2sinA(cos(B-C)-cos(B+C))=1/2,化为2sinA[-2sinBsin(-C)]=1/2,
∴sinAsinBsinC=1/8.
设外接圆的半径为R,由正弦定理可得:a/sinA=b/sinB=c/sinC=2R,由S=1/2absinC,及正弦定理得sinAsinBsinC=(S/2R^2)=1/8,即R^2=4S,
∵面积S满足1≤S≤2,
∴4≤(R^2)≤8,即2≤R≤2√2,
由sinAsinBsinC=1/8可得8≤abc≤16√2,显然选项C,D不一定正确,
A.bc(b+c)>abc≥8,即bc(b+c)>8,正确,
B.ab(a+b)>abc≥8,即ab(a+b)>8,但ab(a+b)>16√2,不一定正确,
故选:A
数列{An}的前n项和为Sn,满足Sn=2nAn+1-3n^2-4n,n属于N*,14年广东高考理科19题有木有大神在啊 求解答
高中文科数学相对理科数学来说是比较简单的,但是其中的公式还是有许多。为了节省同学们整理文科数学公式的时间。下面是由我为大家整理的“高中文科数学公式总结大全”,仅供参考,欢迎大家阅读。
高中文科数学公式总结大全一、对数函数
log.a(MN)=logaM+logN
loga(M/N)=logaM-logaN
logaM^n=nlogaM(n=R)
logbN=logaN/logab(a>0,b>0,N>0 a、b均不等于1)
二、简单几何体的面积与体积
S直棱柱侧=c*h(底面周长乘以高)
S正棱椎侧=1/2*c*h′(底面的周长和斜高的一半)
设正棱台上、下底面的周长分别为c′,c,斜高为h′,S=1/2*(c+c′)*h
S圆柱侧=c*l
S圆台侧=1/2*(c+c′)*l=兀*(r+r′)*l
S圆锥侧=1/2*c*l=兀*r*l
S球=4*兀*R^3
V柱体=S*h
V锥体=(1/3)*S*h
V球=(4/3)*兀*R^3
三、两直线的位置关系及距离公式
(1)数轴上两点间的距离公式|AB|=|x2-x1|
(2) 平面上两点A(x1,y1),(x2,y2)间的距离公式
|AB|=sqr[(x2-x1)^2+(y2-y1)^2]
(3) 点P(x0,y0)到直线l:Ax+By+C=0的距离公式 d=|Ax0+By0+C|/sqr
(A^2+B^2)
(4) 两平行直线l1:=Ax+By+C=0,l2=Ax+By+C2=0之间的距离d=|C1-
C2|/sqr(A^2+B^2)
同角三角函数的基本关系及诱导公式
sin(2*k*兀+a)=sin(a)
cos(2*k*兀+a)=cosa
tan(2*兀+a)=tana
sin(-a)=-sina,cos(-a)=cosa,tan(-a)=-tana
sin(2*兀-a)=-sina,cos(2*兀-a)=cosa,tan(2*兀-a)=-tana
sin(兀+a)=-sina
sin(兀-a)=sina
cos(兀+a)=-cosa
cos(兀-a)=-cosa
tan(兀+a)=tana
四、二倍角公式及其变形使用
1、二倍角公式
sin2a=2*sina*cosa
cos2a=(cosa)^2-(sina)^2=2*(cosa)^2-1=1-2*(sina)^2
tan2a=(2*tana)/[1-(tana)^2]
2、二倍角公式的变形
(cosa)^2=(1+cos2a)/2
(sina)^2=(1-cos2a)/2
tan(a/2)=sina/(1+cosa)=(1-cosa)/sina
五、正弦定理和余弦定理
正弦定理:
a/sinA=b/sinB=c/sinC
余弦定理:
a^2=b^2+c^2-2bccosA
b^2=a^2+c^2-2accosB
c^2=a^2+b^2-2abcosC
cosA=(b^2+c^2-a^2)/2bc
cosB=(a^2+c^2-b^2)/2ac
cosC=(a^2+b^2-c^2)/2ab
tan(兀-a)=-tana
sin(兀/2+a)=cosa
sin(兀/2-a)=cosa
cos(兀/2+a)=-sina
cos(兀/2-a)=sina
tan(兀/2+a)=-cota
tan(兀/2-a)=cota
(sina)^2+(cosa)^2=1
sina/cosa=tana
两角和与差的余弦公式
cos(a-b)=cosa*cosb+sina*sinb
cos(a-b)=cosa*cosb-sina*sinb
两角和与差的正弦公式
sin(a+b)=sina*cosb+cosa*sinb
sin(a-b)=sina*cosb-cosa*sinb
两角和与差的正切公式
tan(a+b)=(tana+tanb)/(1-tana*tanb)
tan(a-b)=(tana-tanb)/(1+tana*tanb)
高中数学知识点速记口诀
1.《集合与函数》
内容子交并补集,还有幂指对函数。性质奇偶与增减,观察图象最明显。
复合函数式出现,性质乘法法则辨,若要详细证明它,还须将那定义抓。
指数与对数函数,两者互为反函数。底数非1的正数,1两边增减变故。
函数定义域好求。分母不能等于0,偶次方根须非负,零和负数无对数;
正切函数角不直,余切函数角不平;其余函数实数集,多种情况求交集。
两个互为反函数,单调性质都相同;图象互为轴对称,Y=X是对称轴;
求解非常有规律,反解换元定义域;反函数的定义域,原来函数的值域。
幂函数性质易记,指数化既约分数;函数性质看指数,奇母奇子奇函数,
奇母偶子偶函数,偶母非奇偶函数;图象第一象限内,函数增减看正负。
2.《三角函数》
三角函数是函数,象限符号坐标注。函数图象单位圆,周期奇偶增减现。
同角关系很重要,化简证明都需要。正六边形顶点处,从上到下弦切割;
中心记上数字1,连结顶点三角形;向下三角平方和,倒数关系是对角,
顶点任意一函数,等于后面两根除。诱导公式就是好,负化正后大化小,
变成税角好查表,化简证明少不了。二的一半整数倍,奇数化余偶不变,
将其后者视锐角,符号原来函数判。两角和的余弦值,化为单角好求值,
余弦积减正弦积,换角变形众公式。和差化积须同名,互余角度变名称。
计算证明角先行,注意结构函数名,保持基本量不变,繁难向着简易变。
逆反原则作指导,升幂降次和差积。条件等式的证明,方程思想指路明。
万能公式不一般,化为有理式居先。公式顺用和逆用,变形运用加巧用;
1加余弦想余弦,1减余弦想正弦,幂升一次角减半,升幂降次它为范;
三角函数反函数,实质就是求角度,先求三角函数值,再判角取值范围;
利用直角三角形,形象直观好换名,简单三角的方程,化为最简求解集;
3.《不等式》
解不等式的途径,利用函数的性质。对指无理不等式,化为有理不等式。
高次向着低次代,步步转化要等价。数形之间互转化,帮助解答作用大。
证不等式的方法,实数性质威力大。求差与0比大小,作商和1争高下。
直接困难分析好,思路清晰综合法。非负常用基本式,正面难则反证法。
还有重要不等式,以及数学归纳法。图形函数来帮助,画图建模构造法。
4.《数列》
等差等比两数列,通项公式N项和。两个有限求极限,四则运算顺序换。
数列问题多变幻,方程化归整体算。数列求和比较难,错位相消巧转换,
取长补短高斯法,裂项求和公式算。归纳思想非常好,编个程序好思考:
一算二看三联想,猜测证明不可少。还有数学归纳法,证明步骤程序化:
首先验证再假定,从K向着K加1,推论过程须详尽,归纳原理来肯定。
5.《复数》
虚数单位i一出,数集扩大到复数。一个复数一对数,横纵坐标实虚部。
对应复平面上点,原点与它连成箭。箭杆与X轴正向,所成便是辐角度。
箭杆的长即是模,常将数形来结合。代数几何三角式,相互转化试一试。
代数运算的实质,有i多项式运算。i的正整数次慕,四个数值周期现。
一些重要的结论,熟记巧用得结果。虚实互化本领大,复数相等来转化。
利用方程思想解,注意整体代换术。几何运算图上看,加法平行四边形,
减法三角法则判;乘法除法的运算,逆向顺向做旋转,伸缩全年模长短。
三角形式的运算,须将辐角和模辨。利用棣莫弗公式,乘方开方极方便。
辐角运算很奇特,和差是由积商得。四条性质离不得,相等和模与共轭,
两个不会为实数,比较大小要不得。复数实数很密切,须注意本质区别。
6.《排列、组合、二项式定理》
加法乘法两原理,贯穿始终的法则。与序无关是组合,要求有序是排列。
两个公式两性质,两种思想和方法。归纳出排列组合,应用问题须转化。
排列组合在一起,先选后排是常理。特殊元素和位置,首先注意多考虑。
不重不漏多思考,捆绑插空是技巧。排列组合恒等式,定义证明建模试。
关于二项式定理,中国杨辉三角形。两条性质两公式,函数赋值变换式。
7.《立体几何》
点线面三位一体,柱锥台球为代表。距离都从点出发,角度皆为线线成。
垂直平行是重点,证明须弄清概念。线线线面和面面、三对之间循环现。
方程思想整体求,化归意识动割补。计算之前须证明,画好移出的图形。
立体几何辅助线,常用垂线和平面。射影概念很重要,对于解题最关键。
异面直线二面角,体积射影公式活。公理性质三垂线,解决问题一大片。
8.《平面解析几何》
有向线段直线圆,椭圆双曲抛物线,参数方程极坐标,数形结合称典范。
笛卡尔的观点对,点和有序实数对,两者一一来对应,开创几何新途径。
两种思想相辉映,化归思想打前阵;都说待定系数法,实为方程组思想。
三种类型集大成,画出曲线求方程,给了方程作曲线,曲线位置关系判。
四件工具是法宝,坐标思想参数好;平面几何不能丢,旋转变换复数求。
解析几何是几何,得意忘形学不活。图形直观数入微,数学本是数形学。
拓展阅读:高中文科数学学哪几本书高中数学(文科):必学部分:必修1、必修2、必修3、必修4、必修5、选修1-1、选修1-2。选学部分:选修4-1(几何证明选讲)、选修4-2(矩阵与变换)、选修4-4(坐标系与参数方程)、选修4-5(不等式选讲)。
预习就是为了对所学知识的初步感知,通过预习,查出障碍;它不仅能培养自学能力,而且能提高学习新课的兴趣,掌握学习的主动权。
新知识的接受,数学能力的培养主要在课堂上进行,所以要特别重视课内的学习效率,寻求正确的学习方法。上课时要紧跟老师的思路,积极展开思维预测下面的步骤,比较自己的解题思路与教师所讲有哪些不同。数学课的听讲要坚持做到“五到”即耳到、眼到、口到、心到、手到。
高中所有理科的公式、知道滴请回复
广东省2014年高考理科数学第19题答案如下:
(1)首先,由Sn的公式可以很容易的求出a1,因为S1=a1,带入到式子中,a1=2a2-7,同时,将n=2代入式子,则S2=a1+a2=4(15-a1-a2)-20,则a1+a2=8,将两式子联立,得a1=3,a2=5,因S3=15,故a3=7,所以a1=3、a2=5、a3=7。以上是第一问的标准解法。
(2)第二问是本题的难点,在解决数列问题时,有很多公式和技巧可以使用,本题则应用了最为普遍的解法:Sn-Sn-1=an,同样地,S(n+1)-Sn=a(n+1),将n+1和n代入Sn的通项公式中,得到如下图的公式:
很显然的,这个式子不是我们需要的通项公式,接下来我们就要利用其他条件了,观察第一问,根据a1=3、a2=5、a3=7,我们不难猜想,an=2n+1,但是猜想终归是猜想,我们需要进行证明,证明采用一种比较常规的证明方法:数学归纳法。
我们分为两种情况进行证明:①当n=1时,代入上面的式子(将中的式子命名为式子a)中,发现式子a符合2n+1这个式子,即证明当n=1时,确实满足an=2n+1。
②仅证明n=1是不可以的,我们需要证明当n=k(k属于n*时)仍然符合式子a,首先我们假设,n=k符合,然后证明n=k+1符合即可,假设n=k符合,则an=2k+1,那么这就是已知条件了,代入式子a,很容易导出,a(k+1)=2k+3=2(k+1)+1,假设n=k符合式子a,证明了n=k+1符合式子a,也就证明了an=2n+1是通项公式,本题作答结束。
本题运用的难点思想就是,需要假设n=k成立,然后证明n=k+1成立,可以这样想,当这个式子不断往后加1都是成立的,就说明这个式子不是只在某一部分符合,就像我们已知了a1、a2,a3,那么证明a4成立,然后已知a4成立,再证明a5成立,这样无穷尽的证明,发现只要k成立,k+1就成立,那么这个式子就是一个符合要求的通项公式。
2019年天津高考理科数学真题试卷及答案与解析
化学
一、非金属单质(F2,Cl2,O2,S,N2,P,C,Si,H)
1、氧化性:
F2+H2===2HF (阴暗处爆炸)
F2+Xe(过量)==XeF2
2F2(过量)+Xe==XeF4 (XeF4是强氧化剂,能将Mn2+氧化为MnO4–)
nF2+2M===2MFn(M表示大部分金属)
2F2+2H2O===4HF+O2 (水是还原剂)
2F2+2NaOH===2NaF+OF2+H2O
F2+2NaCl===2NaF+Cl2
F2+2NaBr===2NaF+Br2
F2+2NaI===2NaF+I2
7F2(过量)+I2===2IF7
F2+Cl2(等体积)===2ClF (ClF属于类卤素:ClF+H2O==HF+HClO )
3F2(过量)+Cl2===2ClF3 (ClF3+3H2O==3HF+HClO3 )
Cl2+H2 2HCl (将H2在Cl2点燃;混合点燃、加热、光照发生爆炸)
3Cl2+2P 2PCl3 Cl2+PCl3 PCl5 Cl2+2Na 2NaCl
3Cl2+2Fe 2FeCl3 Cl2+Cu CuCl2
Cl2+2FeCl2===2FeCl3 (在水溶液中:Cl2+2Fe2+===2Fe3++3Cl )
Cl2+2NaBr===2NaCl+Br2 Cl2+2Br =2Cl +Br2
Cl2+2KI===2KCl+I2 Cl2+2I =2Cl +I2
3Cl2(过量)+2KI+3H2O===6HCl+KIO3
3Cl2+I–+3H2O=6H++6Cl–+IO3–
5Cl2+I2+6H2O===2HIO3+10HCl
5Cl2+I2+6H2O=10Cl–+IO3–+12H+
Cl2+Na2S===2NaCl+S↓ Cl2+S2–=2Cl–+S↓
Cl2+H2S===2HCl+S↓ (水溶液中:Cl2+H2S=2H++2Cl–+S↓
Cl2+SO2+2H2O===H2SO4+2HCl
Cl2+SO2+2H2O=4H++SO42–+2Cl–
Cl2+H2O2===2HCl+O2 Cl2+H2O2=2H++Cl–+O2
2O2+3Fe Fe3O4 O2+K===KO2
S+H2 H2S 2S+C CS2 S+Zn ZnS
S+Fe FeS (既能由单质制取,又能由离子制取)
S+2Cu Cu2S (只能由单质制取,不能由离子制取)
3S+2Al Al2S3 (只能由单质制取,不能由离子制取)
N2+3H2 2NH3 N2+3Mg Mg3N2 N2+3Ca Ca3N2
N2+3Ba Ba3N2 N2+6Na 2Na3N N2+6K 2K3N
N2+6Rb 2Rb3N N2+2Al 2AlN
P4+6H2 4PH3 P+3Na Na3P 2P+3Zn Zn3P2
H2+2Li 2LiH
2、还原性
S+O2 SO2 S+H2SO4(浓) 3SO2↑+2H2O
S+6HNO3(浓) H2SO4+6NO2↑+2H2O
S+4H++6==6NO2↑+2H2O+
3S+4HNO3(稀) 3SO2+4NO↑+2H2O
3S+4H++4 3SO2+4NO↑+2H2O
N2+O2 2NO
4P+5O2 P4O10(常写成P2O5)
2P+3X2 2PX3(X表示F2,Cl2,Br2) PX3+X2 PX5
P4+20HNO3(浓) 4H3PO4+20NO2↑+4H2O
C+2F2 CF4 C+2Cl2 CCl4
C+O2(足量) CO2 2C+O2(少量) 2CO
C+CO2 2CO C+H2O CO+H2(生成水煤气)
2C+SiO2 Si+2CO(制得粗硅)
Si(粗)+2Cl2 SiCl4 (SiCl4+2H2===Si(纯)+4HCl)
Si(粉)+O2 SiO2 Si+C SiC(金刚砂)
Si+2NaOH+H2O==Na2SiO3+2H2↑ (Si+2OH +H2O= +2H2↑)
3、歧化反应
Cl2+H2O==HCl+HClO(加碱或光照促进歧化: (Cl2+H2O H++Cl–+HClO)
Cl2+2NaOH==NaCl+NaClO+H2O (Cl2+2OH–=Cl–+ClO–+H2O)
Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O (Cl2+2OH–=Cl–+ClO–+H2O)
3Cl2+6KOH(浓) 5KCl+KClO3+3H2O (3Cl2+6OH– 5Cl–+ClO3–+3H2O)
3S+6NaOH 2Na2S+Na2SO3+3H2O (3S+6OH– 2S2–+SO32–+3H2O)
4P+3KOH(浓)+3H2O==PH3↑+3KH2PO2 (4P+3OH–+3H2O==PH3↑+3H2PO2–)
11P+15CuSO4+24H2O==5Cu3P+6H3PO4+15H2SO4
3C+CaO CaC2+CO↑
3C+SiO2 SiC+2CO↑
二.金属单质(Na,Mg,Al,Fe,Cu)的还原性
2Na+H2 2NaH 4Na+O2==2Na2O 2Na2O+O2 2Na2O2
2Na+O2 Na2O2 2Na+S==Na2S(爆炸)
2Na+2H2O==2NaOH+H2↑ 2Na+2H2O=2Na++2OH―+H2↑
2Na+2NH3==2NaNH2+H2↑ 2Na+2NH3=2Na++2NH2―+H2↑
4Na+TiCl4 4NaCl+Ti Mg+Cl2 MgCl2 Mg+Br2 MgBr2
2Mg+O2 2MgO Mg+S MgS
2Cu+S Cu2S (Cu2S只能由单质制备)
Mg+2H2O Mg(OH)2+H2↑
2Mg+TiCl4 Ti+2MgCl2 Mg+2RbCl MgCl2+2Rb
2Mg+CO2 2MgO+C 2Mg+SiO2 2MgO+Si
Mg+H2S==MgS+H2
Mg+H2SO4==MgSO4+H2↑ (Mg+2H+=Mg2++H2↑)
2Al+3Cl2 2AlCl3
4Al+3O2===2Al2O3 (常温生成致密氧化膜而钝化,在氧气中燃烧)
4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg(铝汞齐)
4Al+3MnO2 2Al2O3+3Mn 2Al+Cr2O3 Al2O3+2Cr (铝热反应)
2Al+Fe2O3 Al2O3+2Fe 2Al+3FeO Al2O3+3Fe
2Al+6HCl===2AlCl3+3H2↑ 2Al+6H+=2Al3++3H2↑
2Al+3H2SO4===Al2(SO4)3+3H2↑ 2Al+6H+=2Al3++3H2↑
2Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O (Al,Fe在冷,浓的H2SO4,HNO3中钝化)
Al+4HNO3(稀)===Al(NO3)3+NO↑+2H2O Al+4H++NO3–=Al3++NO↑+2H2O
2Al+2NaOH+2H2O===2NaAlO2+3H2↑ 2Al+2OH–+2H2O=2AlO2–+3H2↑
2Fe+3Br2===2FeBr3 3Fe+2O2 Fe3O4 2Fe+O2 2FeO (炼钢过程)
Fe+I2 FeI2
Fe+S FeS (FeS既能由单质制备,又能由离子制备)
3Fe+4H2O(g) Fe3O4+4H2↑
Fe+2HCl===FeCl2+H2↑ Fe+2H+=Fe2++H2↑
Fe+CuCl2===FeCl2+Cu Fe+Cu2+=Fe2++Cu↓
Fe+SnCl4===FeCl2+SnCl2(铁在酸性环境下,不能把四氯化锡完全还原为单质锡Fe+SnCl2==FeCl2+Sn↓ Fe+Sn2+=Fe2++Sn↓
三.非金属氢化物(HF,HCl,H2O,H2S,NH3) 金属氢化物(NaH)
1、还原性:
4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
4H++2Cl–+MnO2 Mn2++Cl2↑+2H2O
4HCl(浓)+PbO2 PbCl2+Cl2↑+2H2O
4H++2Cl–+PbO2 Pb2++Cl2↑+2H2O
4HCl(g)+O2 2Cl2+2H2O
16HCl+2KMnO4===2KCl+2MnCl2+5Cl2↑+8H2O
16 H++10Cl-+2MnO4–=2Mn2++5Cl2↑+8H2O
6HCl+KClO3==KCl+3Cl2↑+3H2O
6H++5Cl–+ClO3–=3Cl2↑+3H2O
14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2↑+7H2O
14H++6Cl–+Cr2O72–=2Cr3++5Cl2↑+7H2O
2H2O+2F2===4HF+O2
2HCl+F2=2HF+Cl2 (F2气与HCl、HBr、HI、H2S、NH3气体不能共存)
2HBr+Cl2=2HCl+Br2 (Cl2气与HBr、HI、H2S、NH3气体不能共存)
2H2S+3O2(足量) 2SO2+2H2O 2H2S+O2(少量) 2S↓+2H2O
2H2S+SO2===3S↓+2H2O H2S+H2SO4(浓)===S↓+SO2↑+2H2O
3H2S+2HNO3(稀)===3S↓+2NO↑+4H2O
3H2S+2H++2NO3–=3S↓+2NO↑+4H2O
5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S↓+8H2O
5H2S+2MnO4–+6H+=2Mn2++5S↓+8H2O
3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S↓+7H2O
3H2S+Cr2O72–+8H+===2Cr3++3S↓+7H2O
H2S+4Na2O2+2H2O===Na2SO4+6NaOH
H2S+4Na2O2+2H2O=8Na++ +
2NH3+3CuO 3Cu+N2+3H2O
2NH3+3Cl2===N2+6HCl 8NH3+3Cl2===N2+6NH4Cl
NH3+NaNO2+HCl==NaCl+N2↑+2H2O
NH3+NO2–+H+=N2↑+2H2O
4NH3+3O2(纯氧) 2N2+6H2O 4NH3+5O2 4NO+6H2O
4NH3+6NO===5N2+6H2O (用氨清除NO)
NaH+H2O===NaOH+H2↑ (生氢剂)
NaH+H2O=Na++OH–+H2↑
4NaH+TiCl4 Ti+4NaCl+2H2↑ CaH2+2H2O=Ca(OH)2↓+2H2↑
2、酸性:
4HF+SiO2===SiF4+2H2O(可测定矿样或钢样中SiO2的含量,玻璃雕刻)
4HF+Si===SiF4+2H2↑
2HF+CaCl2===CaF2+2HCl H2S+Fe===FeS↓+H2↑
H2S+CuCl2===CuS↓+2HCl (弱酸制强酸的典型反应)
H2S+Cu2+=CuS↓+2H+
H2S+2AgNO3===Ag2S↓+2HNO3
H2S+2Ag+=Ag2S↓+2H+
H2S+HgCl2===HgS↓+2HCl
H2S+Hg2+=HgS↓+2H+
H2S+Pb(NO3)2===PbS↓+2HNO3 (铅试纸检验空气中H2S)
H2S+Pb2+=PbS↓+2H+
H2S+2Ag===Ag2S+H2↑(银器在空气中变黑的原因)
2NH3(液)+2Na==2NaNH2+H2↑ (NaNH2+H2O===NaOH+NH3↑)
3、NH3的碱性:
NH3+HX===NH4X (X:F、Cl、Br、I、S)
NH3+HNO3===NH4NO3 NH3+H+=NH4+
2NH3+H2SO4===(NH4)2SO4 NH3+H+=NH4+
NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl(侯德榜制碱:用于工业制备小苏打,苏打)
NH3+H2S==NH4HS NH3+H2S=NH4++HS-
4、不稳定性:
2HF H2+F2 2HCl H2+Cl2 2H2O 2H2+O2
2H2O2===2H2O+O2 H2S H2+S 2NH3 N2+3H2
2HI H2+I2
四.非金属氧化物(SO3、SO2、N2O、NO、N2O3、NO2、N2O4、N2O5、CO、CO2、SiO2、P2O3、P2O5、Cl2O、Cl2O3、Cl2O5、Cl2O7、ClO2)
1、低价态的还原性:(SO2、CO、NO)
2SO2+O2+2H2O===2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)
2SO2+O2 2SO3 SO2+NO2===SO3+NO
SO2+Cl2+2H2O===H2SO4+2HCl Cl2+SO2+2H2O=4H++SO42–+2Cl–
SO2+Br2+2H2O===H2SO4+2HBr Br2+SO2+2H2O=4H++SO42–+2Br–
SO2+I2+2H2O===H2SO4+2HI I2+SO2+2H2O=4H++SO42–+2I–
2NO+O2===2NO2
NO+NO2+2NaOH===2NaNO2(用于制硝酸工业中吸收尾气中的NO和NO2)
NO+NO2+2OH–=2NO2–
2CO+O2 2CO2 CO+CuO Cu+CO2
3CO+Fe2O3 2Fe+3CO2 CO+H2O CO2+H2
2、氧化性:
SO2+2H2S===3S+2H2O
SO3+2KI K2SO3+I2
NO2+2KI+H2O===NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)
4NO2+H2S===4NO+SO3+H2O
2NO2+Cu 4CuO+N2 N2O+Zn ZnO+N2
CO2+2Mg 2MgO+C (CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)
SiO2+2H2 Si+2H2O SiO2+2Mg 2MgO+Si
3、与水的作用:
SO2+H2O===H2SO3
SO3+H2O===H2SO4 SO3+H2O=2H++SO42–
3NO2+H2O===2HNO3+NO (NO2不是硝酸的酸酐)
N2O5+H2O===2HNO3 N2O5+H2O=2H++2NO3–
P2O5+H2O(冷水)===2HPO3
P2O5+3H2O(热水)===2H3PO4 (P2O5极易吸水,可作气体干燥剂)
P2O5+3H2SO4(浓)===2H3PO4+3SO3
CO2+H2O===H2CO3
Cl2O+H2O==2HClO
Cl2O7+H2O==2HClO4 Cl2O7+H2O=2H++2ClO4–
4、与碱性物质的作用:
SO2+2NH3+H2O===(NH4)2SO3
SO2+(NH4)2SO3+H2O===2NH4HSO3
2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2↑(硫酸工业尾气处理)
SO2+Ca(OH)2===CaSO3↓+H2O (不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)
SO3+MgO===MgSO4
SO3+Ca(OH)2===CaSO4↓+H2O
CO2+NH3+H2O===NH4HCO3
CO2+2NH3(过量)+H2O===(NH4)2CO3 (NH4)2CO3 (NH2)2CO+2H2O
CO2+2NH3 (NH2)2CO+H2O (工业制取尿素)
CO2+2NaOH(过量)==Na2CO3+H2O 2OH-+CO2=CO32–+H2O
CO2(过量)+NaOH==NaHCO3 OH-+CO2=HCO3–
CO2+Ca(OH)2(过量)==CaCO3+H2O Ca2++2 +CO2=CaCO3↓+H2O
2CO2(过量)+Ca(OH)2==Ca(HCO3)2 OH―+CO2=HCO3–
CO2+CaCO3+H2O==Ca(HCO3)2 CO2+CaCO3+H2O=Ca2++2HCO3–
CO2(不足)+2NaAlO2+3H2O===2Al(OH)3↓+Na2CO3
CO2+3H2O+AlO2–=Al(OH)3↓+CO32–
CO2(足)+NaAlO2+2H2O===Al(OH)3↓+NaHCO3
CO2+2H2O+AlO2–=Al(OH)3↓+HCO3–
CO2+C6H5ONa+H2O===C6H5OH↓+NaHCO3
CO2+C6H5O―+H2O=C6H5OH↓+HCO3–
SiO2+CaO CaSiO3 (炼钢造渣)
SiO2+2NaOH===Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)
SiO2+Na2CO3 Na2SiO3+CO2 (制取玻璃)
SiO2+CaCO3 CaSiO3+CO2 (制取玻璃)
2NO2+2NaOH==NaNO2+NaNO3+H2O
2NO2+2OH―=NO3–+NO2―+H2O
NO+NO2+2NaOH==2NaNO2+H2O (制取硝酸工业尾气吸收)
NO+NO2+2OH―=2NO3–+H2O
五.金属氧化物
1、低价态的还原性:
6FeO+O2===2Fe3O4
FeO+4HNO3===Fe(NO3)3+NO2+2H2O
FeO+4H++NO3―=Fe3++NO2↑+2H2O
2、氧化性:
Na2O2+2Na 2Na2O(此反应用于制备Na2O)
MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al.一般通过电解制Mg和Al.
Fe2O3+3H2 2Fe+3H2O(制还原铁粉)
Fe3O4+4H2 3Fe+4H2O CuO+H2 Cu+H2O
2Fe3O4+16HI==6FeI2+8H2O+2I2
2Fe3O4+16H++4I―=6Fe2++8H2O+2I2
Fe2O3+Fe 3FeO (炼钢过程中加入废钢作氧化剂)
FeO+C Fe+CO (高温炼钢调节C含量)
2FeO+Si 2Fe+SiO2 (高温炼钢调节Si含量)
3、与水的作用:
Na2O+H2O==2NaOH
Na2O+H2O=2Na++2OH–
2Na2O2+2H2O===4NaOH+O2↑
2Na2O2+2H2O=4Na++4OH–+O2↑
(此反应分两步:Na2O2+2H2O===2NaOH+H2O2;2H2O2===2H2O+O2 H2O2的制备可利用类似的反应:BaO2+H2SO4(稀)===BaSO4+H2O2)
MgO+H2O===Mg(OH)2(缓慢反应)
4、与酸性物质的作用:
Na2O+SO3==Na2SO4 Na2O+CO2==Na2CO3 MgO+SO3===MgSO4
Na2O+2HCl==2NaCl+H2O
Na2O+2H+=2Na++H2O
2Na2O2+2CO2==2Na2CO3+O2↑
Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2
MgO+H2SO4===MgSO4+H2O
MgO+2H+=Mg2++H2O
Al2O3+3H2SO4===Al2(SO4)3+3H2O
Al2O3+6H+=2Al3++3H2O
Al2O3+2NaOH===2NaAlO2+H2O (Al2O3两性氧化物)
Al2O3+2OH―=2AlO2―+H2O
FeO+2HCl===FeCl2+H2O
FeO+2H+=Fe2++H2O
Fe2O3+6HCl===2FeCl3+3H2O
Fe?2O3+6H+=2Fe3++3H2O
Fe3O4+8HCl===FeCl2+2FeCl3+4H2O
Fe?3O4+8H+=2Fe3++Fe2++4H2O
生物
Ⅰ.生物代谢的相关计算
主要是根据光合作用和呼吸作用的有关反应式的计算:
1.根据反应式中原料与产物之间的关系进行简单的化学计算,这类题目的难度不大。
2.有关光合作用强度和呼吸作用强度的计算:
一般以光合速率和呼吸速率(即单位时间单位叶面积吸收和放出CO2的量或放出和吸收O2的量)来表示植物光合作用和呼吸作用的强度,并以此间接表示植物合成和分解有机物的量的多少。
(1)光合作用实际产氧量 = 实测的氧气释放量 + 呼吸作用吸耗氧量
(2)光合作用实际二氧化碳消耗量 = 实测的二氧化碳消耗量 + 呼吸作用二氧化碳释放量
(3)光合作用葡萄糖净生产量 = 光合作用实际葡萄糖生产量-呼吸作用葡萄糖消耗量
(呼吸速率可在黑暗条件下测得)
3.有关有氧呼吸和无氧呼吸的混合计算:
在关于呼吸作用的计算中,在氧气充足的条件下,完全进行有氧呼吸,在绝对无氧的条件下,只能进行无氧呼吸。设计在这两种极端条件下进行的有关呼吸作用的计算,是比较简单的。但如果在低氧条件下,既进行有氧呼吸又进行无氧呼吸,设计的计算题就复杂多了,解题时必须在呼吸作用释放出的CO2中,根据题意确定有多少是无氧呼吸释放的,有多少是有氧呼吸释放的。呼吸作用的底物一般是葡萄糖,以葡萄糖作为底物进行有氧呼吸时,吸收的O2和释放的CO2的量是相等的,但如以其他有机物作为呼吸底物时,吸收的O2和释放的CO2就不一定相等了,在计算时一定要写出正确反应方程式,并且要正确配平后才进行相关的计算。
Ⅱ.生物的生长、发育、繁殖的相关计算
一、细胞分裂各期的染色体、DNA、同源染色体、四分体等数量计算
该种题型主要有两种出题方法:
1.给出细胞分裂某个时期的分裂图,计算该细胞中的各种数目。该种情况的解题方法是在熟练掌握细胞分裂各期特征的基础上,找出查各种数目的方法:
(1)染色体的数目=着丝点的数目
(2)DNA数目的计算分两种情况:
●当染色体不含姐妹染色单体时,一个染色体上只含有一个DNA分子;
●当染色体含有姐妹染色单体时,一个染色体上含有两个DNA分子。
(3)同源染色体的对数在有丝分裂各期、减Ⅰ分裂前的间期和减数第一次分裂期为该时期细胞中染色体数目的一半,而在减数第二次分裂期和配子时期由于同源染色体已经分离进入到不同的细胞中,因此该时期细胞中同源染色体的数目为零。
(4)在含有四分体的时期(联会时期和减Ⅰ中期),四分体的个数等于同源染色体的对数。
2.无图,给出某种生物细胞分裂某个时期细胞中的某种数量,计算其它各期的各种数目。
该种题型的解题方法可在熟练掌握上种题型的解题方法的基础上,归纳出各期的各种数量变化,并找出规律。如下表:
间期 有丝分裂 减Ⅰ分裂 减Ⅱ分裂 配子
前、中期 后期 末期 前期 中期 后期 前期 中期 后期
染色体(条) 2N 2N 4N 2N 2N 2N 2N N N 2N N
DNA(个) 2C→4C 4C 4C 2C 4C 4C 4C 2C 2C 2C C
同源染色体(对) N N 2N N N N N 无 无 无 无
四分体(个) 无 无 无 无 N N 无 无 无 无 无
二、关于配子的种类
1.一个性原细胞进行减数分裂,
(1)如果在染色体不发生交叉互换,则可产生4个2种类型的配子,且两两染色体组成相同,而不同的配子染色体组成互补。
(2)如果染色体发生交叉互换(只考虑一对同源染色体发生互换的情况),则可产生四种类型的配子,其中亲本类型2种(两种配子间染色体组成互补),重组类型2种(两种配子间染色体组成互补)(可参照教材106页图5-11进行分析)
2.有多个性原细胞,设每个细胞中有n对同源染色体,进行减数分裂
(1)如果染色体不发生交叉互换,则可产生2n种配子
(2)如果有m对染色体发生互换,则可产生2n+m种配子。
(分析:据规律(1)中的②结论可推知:互换了m对,可产生4m种配子;据规律(2)中的①结论可推知:没发生互换的有n-m对,可产生2n-m种配子;则共产生配子的种类为:2n-m×4m=2n+m种。
三、关于互换率的计算
有A个性原细胞进行减数分裂,若有B个细胞中的染色体发生了互换,则
1.发生互换的性原细胞的百分率=B/A×100%
2.在产生的配子中,重组类型的配子占总配子数的百分率(即互换率)=2B/4A×100%=B/2A×100%
3.产生新类型(重组类型)的配子种类:2种
每种占总配子数的百分率=B/4A×100%
四、与生物个体发育的相关计算:
1.一个胚珠(内产生一个卵细胞和两个级核,进行双受精)发育成一粒种子;一个子房发育成一个果实;
2.若细胞中染色体数为2N,则精子、卵细胞、极核内的染色体数都为N;受精卵→胚细胞中染色体数为2N(来自父、母方的染色体各占1/2),受精极核→胚乳细胞中染色体数为3N(来自父方的占1/3,母方的占2/3,且与精子结合的两个极核的基因型和与另一个精子结合的卵细胞的基因型是相同的),种皮、果皮等结构的染色体数为2N(全部来自母方)。
Ⅲ.生物的遗传、变异、进化相关计算
一、与遗传的物质基础相的计算:
1.有关氨基酸、蛋白质的相关计算
(1)一个氨基酸中的各原子的数目计算:
C原子数=R基团中的C原子数+2,H原子数=R基团中的H原子数+4,O原子数=R基团中的O原子数+2,N原子数=R基团中的N原子数+1
(2)肽链中氨基酸数目、肽键数目和肽链数目之间的关系:
若有n个氨基酸分子缩合成m条肽链,则可形成(n-m)个肽键,脱去(n-m)个水分子,至少有-NH2和-COOH各m个。
(3)氨基酸的平均分子量与蛋白质的分子量之间的关系:
n个氨基酸形成m条肽链,每个氨基酸的平均分子量为a,那么由此形成的蛋白质的分子量为:n?a-(n-m)?18 (其中n-m为失去的水分子数,18为水的分子量);该蛋白质的分子量比组成其氨基酸的分子量之和减少了(n-m)?18。
(4)在R基上无N元素存在的情况下,N原子的数目与氨基酸的数目相等。
2.有关碱基互补配对原则的应用:
(1)互补的碱基相等,即A=T,G=C。
(2)不互补的两种碱基之和与另两种碱基之和相等,且等于50%。
(3)和之比 在双链DNA分子中:
●能够互补的两种碱基之和与另两种碱基之和的比同两条互补链中的该比值相等,即:(A+T)/(G+C)=(A1+T1)/(G1+C1)=(A2+T2)/(G2+C2);
●不互补的两种碱基之和与另两种碱基之和的比等于1,且在其两条互补链中该比值互为倒数,即:(A+G)/(T+C)=1;(A1+G1)/(T1+C1)=(T2+C2)/(A2+G2)
(4)双链DNA分子中某种碱基的含量等于两条互补链中该碱基含量和的一半,即A=(A1+A2)/2(G、T、C同理)。
3.有关复制的计算:
(1)一个双链DNA分子连续复制n次,可以形成2n个子代DNA分子,且含有最初母链的DNA分子有2个,占所有子代DNA分子的比例为 。(注意:最初母链与母链的区别)
(2)所需游离的脱氧核苷酸数=M×(2n-1),其中M为的所求的脱氧核苷酸在原来DNA分子中的数量。
4.基因控制蛋白质的生物合成的相关计算:
(1)mRNA上某种碱基含量的计算:运用碱基互补配对原则,把所求的mRNA中某种碱基的含量归结到相应DNA模板链中互补碱基上来,然后再运用DNA的相关规律。
(2)设mRNA上有n个密码子,除3个终止密码子外,mRNA上的其它密码子都控制一个氨基酸的连接,需要一个tRNA,所以,密码子的数量:tRNA的数量:氨基酸的数量=n:n:n。
(3)在基因控制蛋白质合成过程中,DNA、mRNA、蛋白质三者的基本组成单位脱氧核苷酸(或碱基)、核糖核苷酸(或碱基)、氨基酸的数量比例关系为6:3:1。
5.设一个DNA分子中有n个碱基对,则这些碱基对可能的排列方式就有4n种,也就是说可以排列成4n个DNA分子。
6.真核细胞基因中外显子的碱基对在整个基因中所占的比例=(编码的氨基酸的个数×3÷该基因中的总碱基数)×100%。
二、有关遗传基本规律的计算:
1.一对相对性状的杂交实验中:
(1)F1产生的两种雌雄配子的几率都是1/2;
(2)在F2代中,共有3种基因型,其中纯合子有2种(显性纯合子和隐性纯合子),各占1/4,共占1/2,杂合子有一种,占1/2;
(3)在F2代中,共有2种表现型,其中显性性状的几率是3/4,隐性性状的几率是1/4,在显性性状中,纯合子的几率是1/3,杂合子的几率是2/3。
(4)一对等位基因的杂合子连续自净n代,在Fn代中杂合子占(1/2)n,纯合子占1-(1/2)n
2.两对相对性状的杂交实验中:
(1)F1双杂合子产生四种雌雄配子的几率都是1/4;
(2)在F2中,共有9种基因型,各种基因型的所占几率如下表:
F2代基因型的类型 对应的基因型 在F2代中出现的几率
纯合子 YYRR、YYrr、yyRR、yyrr 各占1/16
杂合子 一纯一杂 YYRr、yyRr、YyRR、Yyrr 各占2/16
双杂合 YyRr 占4/16
(3)在F2代中,共有四种表现型,其中双显性性状有一种,几率为9/16(其中的纯合子1种,占1/9,一纯一杂2种,各占2/9,双杂合子1种,占4/9),一显一隐性状有2种,各占3/16(其中纯合子2种,各占1/6,一纯一杂2种,各占2/6),共占6/16,双隐性性状有一种,占1/16。
3.配子的种类数=2n种(n为等位基因的对数)。
4.分解组合法在自由组合题中的应用:
基因的自由组合定律研究的是控制两对或多对相对性状的基因位于不同对同源染色体上的遗传规律。由于控制生物不同性状的基因互不干扰,独立地遵循基因的分离定律,因此,解这类题时我们可以把组成生物的两对或多对相对性状分离开来,用基因的分离定律一对对加以研究,最后把研究的结果用一定的方法组合起来,即分解组合法。这种方法主要适用于基因的自由组合定律,其大体步骤是:
●先确定是否遵循基因的自由组合定律。
●分解:将所涉及的两对(或多对)基因或性状分离开来,一对对单独考虑,用基因的分离定律进行研究。
●组合:将用分离定律研究的结果按一定方式进行组合或相乘。
三、基因突变和染色体变异的有关计算:
1.正常细胞中的染色体数=染色体组数×每个染色体组中的染色体数
2.单倍体体细胞中的染色体数=本物种配子中的染色体数=本物种体细胞中的染色体数÷2
3.一个种群的基因突变数=该种群中一个个体的基因数×每个基因的突变率×该种群内的个体数。
四、基因频率和基因型频率的计算:
1.求基因型频率:
设某种群中,A的基因频率为p,a的基因频率为q,则AA、Aa、aa的基因型频率的计算方法为:
p+q=1,(p+q)2=1,p2+2pq+q2=1,即AA+2Aa+aa=1,所以AA%=p2,Aa%=2pq,aa%=q2。
说明:此结果即“哈代-温伯格定律”,此定律需要以下条件:①群体是极大的;②群体中个体间的交配是随机的;③没有突变产生;④没有种群间个体的迁移或基因交流;⑤没有自然选择。因此这个群体中各基因频率和基因型频率就可一代代稳定不变,保持平衡。
2.求基因频率:
(1)常染色体遗传:
●通过各种基因型的个体数计算:一对等位基因中的一个基因频率=(纯合子的个体数×2+杂合子的个体数)÷总人数×2
●通过基因型频率计算:一对等位基因中的一个基因频率=纯合子基因型频率+1/2×杂合子基因型频率
(2)伴性遗传:
●X染色体上显性基因的基因频率=雌性个体显性纯合子的基因型频率+雄性个体显性个体的基因型频率+1/2×雌性个体杂合子的基因型频率。隐性基因的基因型频率=1-显性基因的基因频率。
●X染色体上显性基因的基因频率=(雌性个体显性纯合子的个体数×2+雄性个体显性个体的个体数+雌性个体杂合子的个体数)÷雌性个体的个体数×2+雄性个体的个体数)。隐性基因的基因型频率=1-显性基因的基因频率。
(3)复等位基因:
对哈迪-温伯格定律做相应调整,公式可改为:(p+q+r)2=p2+q2+r2+2pq+2pr+2qr=1,p+q+r=1。p、q、r各复等位基因的基因频率。
Ⅳ.生物与环境的相关计算
1.关于种群数量的计算:
(1)用标志重捕法来估算某个种群数量的计算方法:
种群数量[N]=第一次捕获数×第二次捕获数÷第二捕获数中的标志数
(2)据种群增长率计算种群数量:
设种群的起始数量为N0,年增长率为λ(保持不变),t年后该种群的数量为Nt,则:
Nt=N0λt
2.能量传递效率的计算:
(1)能量传递效率=上一个营养级的同化量÷下一个营养级的同化量×100%
(2)同化量=摄入量-粪尿量
字数有限,物理有人回答了就不多说了。数学的挤不下了。不过你可以在百度知道上查找,很全的。
祝你好运!o(∩_∩)o...
重庆2021年高考数学平均分
2019年天津高考理科数学真题试卷及答案与解析
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共150分,考试用时120分钟。第Ⅰ卷1至2页,第Ⅱ卷3-5页。
答卷前,考生务必将自己的姓名、准考号填写在答题卡上,并在规定位置粘贴考试用条形码。答卷时,考生务必将答案涂写在答题卡上,答在试卷上的无效。考试结束后,将本试卷和答题卡一并交回。
祝各位考生考试顺利!
第Ⅰ卷
注意事项:
1.每小题选出答案后,用铅笔将答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。
2.本卷共8小题,每小题5分,共40分。
参考公式:
一、选择题:在每小题给出的四个选项中,只有一项是符合题目要求的.
第Ⅱ卷
注意事项:
1.用黑色墨水的钢笔或签字笔将答案写在答题卡上。
2.本卷共12小题,共110分。
二.填空题:本大题共6小题,每小题5分,共30分.
三.解答题:本大题共6小题,共80分.解答应写出文字说明,证明过程或演算步骤.
?
?
2019年天件理科数学真题试卷参考答案
一.选择题:本题考查基本知识和基本运算.每小题5分,满分40分.
1.D 2.C 3.B 4.B 5.D 6.A
7.A 8.C
二.填空题:本题考查基本知识和基本运算.每小题5分,满分30分.
三.解答题
15.本小题主要考查同角三角函数的基本关系,两角和正弦公式,二倍角的正弦与余弦公式,以及正弦定理、余弦定理等基础知识.考查运算求解能力,满分13分.
,
16.本小题主要考查离散型随机变量的分布列与数学期望,互斥事件和相互独立事件的概率计算公式等基础知识.考查运用概率知识解决简单实际问题的能力.满分13分.
17.本小题主要考查直线与平面平行、二面角、直线与平面所成的角等基础知识.考查用空间向量解决立体几何问题的方法.考查空间想象能力、运算求解能力和推理论证能力.满分13分.
18.本小题主要考查椭圆的标准方程和几何性质、直线方程等基础知识。考查用代数方法研究圆锥曲面的性质.考查运算求解能力,以及用方程思想解决问题的能力.满分13分.
19.本小题主要考查等差数列、等比数列的通项公式及其前 项和公式等基础知识.考查化归与转化思想和数列求和的基本方法以及运算求解能力.满分14分.
20.本小题主要考查导数的运算、不等式证明、运用导数研究函数的性质等基础知识和方法.考查函数思想和化归与转化思想.考查抽象概括能力、综合分析问题和解决问题的能力.满分14分.
69分。根据查询重庆市教育局相关信息得知,2021年重庆高考理科数学平均分为69分,是处于较低的一个分数,属于不及格成绩。平均分是指一组数据的总和除以数据个数的结果,计算公式为:平均分=总分÷数据个数。
下一篇:高考美术资料_高考美术内容